Ce secrete despre HEXI PHARMA a vrut să afle o firmă concurentă, făcând presiuni asupra Ministerului Sănătății. Informații în EXCLUSIVITATE
• Septembrie 2013 - GB INDCO solicită Ministerului Sănătății informații despre HEXI PHARMA • Martie 2014 - ministerul e dat în judecată, ca urmare a refuzului • Ianuarie 2015 - Tribunalul București respinge acțiunea, ca neîntemeiată • Septembrie 2015 - Curtea de Apel București respinge și recursul, decizia fiind definitivă • Octombrie 2015 - GB INDCO își exprimă dorința de a cumpăra HEXI PHARMA, conform EVZ • Decembrie 2015 – pe fondul tragediei de la Colectiv, la presă ajung documente despre diluarea dezinfectanților HEXI PHARMA • Aprilie 2015 - începe seria dezvăluirilor, iar firma lui Dan Condrea intră sub tăvălug
Ȋn povestea dezinfectanților de la HEXI PHARMA, firma GB INDCO a apărut în episodul 12 al dezvăluirilor lui Cătălin Tolontan. Cu răpăit de tobe și sunet de trompete. „Alexandru Vârgolici patronează GB Indco, unicul importator al produselor Anios”, se preciza pe www.tolo.ro. „Fondată de Fernard Collet Delval în anul 1898 în Lille, Laboratoires Anios, acesta este numele oficial, reprezintă cel mai important producător de dezinfectanți al lumii. (...) Cum ajunge o companie pharma cu o istorie mai veche decât cea a antibioticelor parte într-o criză de sănătate publică din România?”
Simplu. Un epidemiolog, a cărui identitate a fost protejată, declara la 9 mai a.c., în episodul precedent din serialul de dezvăluiri de pe www.tolo.ro, că Anios ar fi trucat licitația pentru dezinfectanți a unui spital județean, despre această ilegalitate fiind informat inclusiv SRI. Epidemiologul susținea și că produsele Anios nu îndeplinesc standardele de testare.
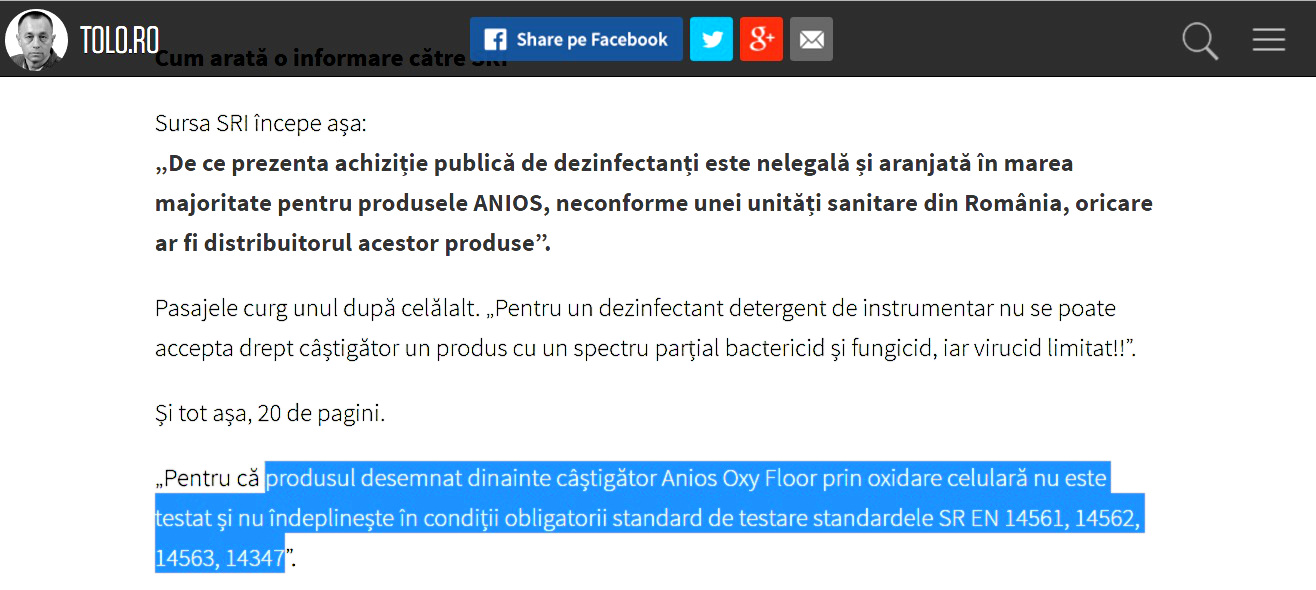
Au trecut patru luni de la această dezvăluire. Ați văzut pe careva ducând vreun bidon de la Anios la laborator, pentru analize? Ați citit pe undeva că Ministerul Sănătății s-a grăbit să efectueze testările necesare, fie și la un laborator neomologat, așa cum s-a întâmplat în cazul produselor HEXI PHARMA?
Subiectul cu Anios s-a diluat imediat, prin fentă. Episodul de a doua zi a fost intitulat „Liderul mondial Anios a dat în judecată Ministerul Sănătății, pentru că a acoperit dezinfectanții diluați de la HEXI PHARMA. Francezii descoperiseră încă din 2012 coruperea produselor”. De unde știm asta? Ne-o spune Alexandru Vârgolici, administrator al SC GB INDCO SRL, unic importator al produselor Anios în România.
„Noi, GB Indco, am avut un proces cu Ministerul Sănătății, care a durat din 2013 și până în 2015. Am vrut să verificăm felul în care Comisia de Biocide a eliberat avizul pentru câteva produse ale Hexi Pharma. Și am cerut testele de eficiență pe produsele lor. (...) Nu ni le-au dat. Am apelat la justiție împotriva Ministerului Sănătății, pentru că această Comisie de Biocide nu are personalitate juridică, dar aparține de minister. Am pierdut și la fond, și la apel. Doi ani au durat procesele. După părerea noastră, acele analize de performanță ale produselor ar fi trebuit să fie publice, dar dacă așa a decis justiția, ne-am conformat”, declara Vârgolici pentru www.tolo.ro.
Administratorul SC GB INDCO SRL susținea că a cerut testele din dosarele de avizare ale produselor HEXI PHARMA pentru că „am făcut în 2012 analize la laboratoarele Anios. Am descoperit ceva în neregulă, am vrut să verificăm cum de au primit avizul și să facem public totul, justiția a decis altceva, m-am supus. De ce Comisia de Biocide nu ne-a arătat testele lui Hexi?”
Vă spunem noi de ce. ActiveNews a intrat în posesia motivării deciziei prin care Secția a II-a Contencios Administrativ și Fiscal a Tribunalului București a respins plângerea făcută de SC GB INDCO SRL împotriva Ministerului Sănătății. Care n-a fost dat în judecată „pentru că a acoperit dezinfectanții diluați”, ci pentru că a refuzat să ofere unei firme concurente informații despre HEXI PHARMA.
Se cereau date despre furnizori - „numele și adresa producătorului de substanțe active”
De fapt, GB INDCO nu solicitase doar testele de eficiență din avizele acordate de Comisia de Biocide pentru produsele HEXI PHARMA. De altfel, o parte dintre aceste avize sunt publice.
Ȋn septembrie 2013, SC GB INDCO SRL ceruse Ministerului Sănătății să-i furnizeze despre HEXI PHARMA toate informațiile prevăzute de art. 66 alin. 3 din Regulamentul UE 528/2012 privind punerea la dispoziție pe piață și utilizarea produselor biocide (doc. 2 RegulamentUEnr.2012_528_consolidat_25_04_2014).


Ȋn noiembrie 2013, Ministerul Sănătății le-a comunicat celor de la SC GB INDACO SRL că refuză furnizarea informațiilor solicitate, deoarece în cauză era vorba de produse biocide autorizate înainte de adoptarea Regulamentului UE. „Totodată, potrivit art. 92 din Regulament, «produsele biocide pentru care a fost emisă o autorizație sau care au fost înregistrare în conformitate cu articolul 3, 4, 15 sau 17 din Direcțiva 98/8/CE, înainte de 1 septembrie 2013, pot fi puse în continuare la dispoziție pe piață, cu respectarea condițiilor de autorizare sau înregistrare stipulate în directiva menționată, și utilizate până la data expirării autorizației sau înregistrării sau până la anularea acesteia”, argumenta Ministerul Sănătății, menționând și că „unele din informațiile solicitate sunt publice și afișate pe website-ul www.ms.ro, în Registrul Național al Produselor Biocide”.
Nemulțumită de răspunsul primit, SC GB INDACO SRL a dat în judecată Ministerul Sănătății . Tribunalul București a analizat dacă informațiile solicitate erau de interes public sau intrau în categoria celor exceptate de la accesul liber, prev. de art.12 din legea 544/2001. Astfel, în motivarea deciziei sale, judecătorul a subliniat că produsele HEXI PHARMA despre care GB INDCO solicitase informații la Ministerul Sănătății fuseseră avizate pentru a fi plasate pe piața internă potrivit Ordinului nr. 10/368/11/2010, privind aprobarea procedurii de avizare a produselor biocide. Acest act normativ a continuat să funcționeze și după data de 1 septembrie 2013, în baza art. 89 alin. 2 din Regulamentul UE, care prevedea că „(...) un stat membru poate continua să aplice sistemul propriu sau practica proprie în vigoare de punere la dispoziție pe piață a unui produs biocid dat pentru o perioadă de până la doi ani de la data aprobării ultimei substanțe active care urmează să fie aprobată din respectivul produs biocid”.
Ori art. 66 alin. 3 din Regulamentul UE, în baza căruia GB INDCO făcuse solicitarea către Ministerul Sănătății, preciza că „se acordă, în toate cazurile, accesul la informații, după obținerea autorizației”. Conform aceluiași Regulament, noțiunea de „autorizație” înseamnă o autorizație națională, o autorizație a Uniunii sau o autorizație solicitată Agenției Europeane pentru Produse Chimice și eliberată de autoritatea competentă a statului membru.
Potrivit art. 19 alin. 1 lit. a din Regulament, „un produs biocid este autorizat dacă substanțele active sunt aprobate pentru tipurile de produse relevante și toate condițiile specificate pentru substanțele active în cauză îndeplinite”. Judecătorul a precizat, în motivarea de respingere de plângerii GB INDACO, că „nicio substanță activă conținută de produsele biocide în cauză (n.r. – ale HEXI PHARMA) nu este aprobată”, în acest caz fiind aplicabilă prevederea din Regulament conform căreia există obligația statelor membre de a autoriza produsele biocide în termen de trei ani de la data aprobării Regulamentului.
Mai mult, „unele informații solicitate, cum ar fi numele și adresa producătorului de substanțe active, nu sunt disponibile la nivelul Comisiei Naționale pentru Produse Biocide, deoarece nu se regăsesc printre elementele avizului produsului biocid, așa cum prevede Ordinul 10/368/11/2010, sensul sintagmei «autorizație națională» din definiția de la art. 3 alin. 1 lit. o din Regulament, ce face obiectul prevederilor de la art. 29 coroborat cu art. 17 din Regulament, fiind diferit de cel al termenului «aviz» in accepțiunea art. 2 lit. a din Ordinul 10/368/11/2010”, se precizează în motivarea instanței.
„Având în vedere considerentele ce preced, tribunalul apreciază că nu se poate reține existența unui refuz nejustificat din partea pârâtei de a comunica informațiile solicitate, nefiind vorba de informații cu caracter public în sensul dispozițiilor Legii 544/2001, ci de informații pentru care accesul este condiționat de obținerea autorizației prevăzute de lege, pe cale de consecință va respinge acțiunea formulată, ca neîntemeiată.”
Decizia a fost comunicată de Tribunalul București la 27 ianuarie 2015, iar SC GB INDCO SRL a făcut recurs. La 14 septembrie 2015, Secția a VIII-a contencios administrativ și fiscal a Curții de Apel București a respins și „cererea de sesizare a Curții de Justiție a Uniunii Europene”, dar și recursul, ca nefondat. Decizie era definitivă.
După numai câteva luni, a izbucnit scandalul HEXI PHARMA.
Accesul la informații poate fi refuzat, dacă el ar afecta protecția intereselor comerciale
Interesant este că art. 66, alin.(2) din Regulamentul UE invocat de GB INDCO în instanțele din România prevede că „Agenția Europeană pentru Produse Chimice și autoritățile competente refuză accesul la informații în cazul în care divulgarea ar afecta protecția intereselor comerciale sau viața privată și siguranța persoanelor vizate. În mod normal, se consideră că divulgarea următoarelor informații aduce atingere intereselor comerciale sau vieții private și siguranței persoanelor vizate: detalii privind compoziția completă a produsului biocid; cantitatea exactă de substanță activă sau de produs biocid fabricat sau pus la dispoziție pe piață; legăturile dintre producătorul unei substanțe active și persoana responsabilă de introducerea unui produs biocid pe piață sau dintre persoana responsabilă de introducerea unui produs biocid pe piață și distribuitorii produsului; (...). Cu toate acestea, în cazul în care este esențial să se acționeze de urgență pentru protejarea sănătății umane, a sănătății animale, a siguranței publice sau a mediului sau din alte motive de interes public major, Agenția sau autoritățile competente dezvăluie informațiile menționate la prezentul alineat.”
Din motivarea deciziei Tribunalului București nu rezultă că SC GB INDCO SRL și-ar fi argumentat solicitarea de informații invocând că „este esențial să se acționeze de urgență pentru protejarea sănătății umane”, deși administratorul acestei societăți a susținut, ulterior, că informațiile despre produsele HEXI PHARMA fuseseră cerute după ce în laboratoarele Anios s-ar fi descoperit „ceva în neregulă” cu acești dezinfectanți.
Ȋn 2014, când GB INDCO era în proces cu Ministerul Sănătății pentru obținerea informațiilor despre HEXI PHARMA, piața dezinfectanților din România era dominată de trei firme: SANTE INTERNATIONAL, cu o cotă de piață de 33%, GB INDCO - 17% și HEXI PHARMA - 13%, după cum arată un studiu publicat de ICAP România în luna mai a acestui an.
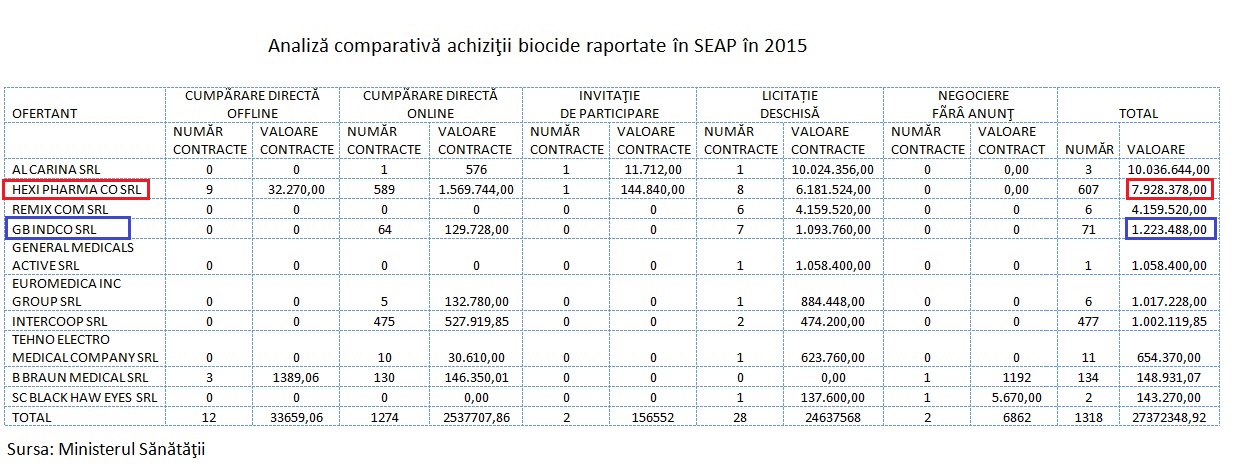
Ȋn 2015, podiumul s-a modificat. Ministerul Sănătății a publicat, tot în luna mai, lista tuturor contractelor de achiziții de substanțe biocide raportate în SEAP anul trecut, dar și o analiză comparativă, conform căreia HEXI PHARMA se afla pe poziția a doua, cu 607 contracte, în valoare totală de 7.928.378 RON, iar GB INDACO pe poziția a patra, cu 71 de contracte (1.223.488 RON).
Anul trecut, în octombrie, GB INDACO și-a exprimat dorința de a cumpăra HEXI PHARMA, oferindu-i lui Dan Condrea 5 milioane de euro, scrie ziarul Evenimentul Zilei. Dan Condrea a plusat și a cerut 8 milioane, iar tranzacția nu a mai avut loc.
Anul acesta, HEXI PHARMA a ieșit, de nevoie, de pe piață, iar la 22 mai Dan Condrea și-a pierdut viața într-un accident rutier despre care Parchetul General a concluzionat că „nu a fost consecința vreunei fapte prevăzute de legea penală”.
Donează pentru ActiveNews!
ActiveNews nu a primit niciodată altă publicitate decât cea automată, de tip Google, din care o îndepărtăm pe cea imorală. Aceasta însă nu ne asigură toate costurile.
Ziarele incomode sunt sabotate de Sistem. Presa din România primeste publicitate (adică BANI) doar în măsura în care este parte a Sistemului sau/și a Rețelei Soros. Sau dacă se supune, TACE sau MINTE.
ActiveNews NU vrea să se supună. ActiveNews NU vrea să tacă. ActiveNews NU vrea să mintă. ActiveNews VREA să rămână exclusiv în slujba Adevărului și a cititorilor.
De aceea, are nevoie de cititorii săi pentru a supraviețui așa cum este acum. Dacă și tu crezi în ceea ce credem noi, te rugăm să ne sprijini să luptăm în continuare pentru Adevăr, pentru România!
ActiveNews nu a primit niciodată altă publicitate decât cea automată, de tip Google, din care o îndepărtăm pe cea imorală. Aceasta însă nu ne asigură toate costurile.
Ziarele incomode sunt sabotate de Sistem. Presa din România primeste publicitate (adică BANI) doar în măsura în care este parte a Sistemului sau/și a Rețelei Soros. Sau dacă se supune, TACE sau MINTE.
ActiveNews NU vrea să se supună. ActiveNews NU vrea să tacă. ActiveNews NU vrea să mintă. ActiveNews VREA să rămână exclusiv în slujba Adevărului și a cititorilor.
De aceea, are nevoie de cititorii săi pentru a supraviețui așa cum este acum. Dacă și tu crezi în ceea ce credem noi, te rugăm să ne sprijini să luptăm în continuare pentru Adevăr, pentru România!
RO02BTRLRONCRT0563030301 (lei) | RO49BTRLEURCRT0563030301 (euro)
Pe același subiect

Omoruri ”pandemice” la Spitalul Sf. Pantelimon din București? "Se micșorează deliberat doza de noradrenalină pentru a se elibera paturile din salonul ATI după decesul provocat al pacienților". Jurnaliștii de la Cetățeanul.net: Nu am mai întâlnit așa ceva!

17 milioane de morți ai vaccinului și o tută. ”Amanta lui Cîțu” contrazice un studiu de 180 de pagini efectuat în 17 țări de oameni de știință cu reputație internațională cât și pe Tucker Carlson. Factual, ONG-ul cu un capital de 2.500.000 lei

Zoe Dantes: Când te întorci din morți!

Un medic apreciat a murit subit la doar 41 de ani. Dr. Ștefan Veliceasa ar fi decedat în urma unui accident vascular, în trafic, la volan

Dezvăluiri: Asociația Americană a Inimii a fost plătită de Procter & Gamble pentru a susține că bolile de inimă sunt cauzate de grăsimi saturate, nu de uleiuri vegetale și zahăr

Dezvăluiri cutremurătoare făcute de rudele indignate ale unui pacient mort la Spitalul Pantelimon. Modul inuman cum era tratat de cadrele medicale - “Tot luptă, lăsați-l să moară!” - VIDEO
Recomandările noastre

Orwell a prezis Războiul Permanent de astăzi

CNSAS a declanșat procedura de verificare a lui VASILE BĂNESCU. Purtătorul de cuvânt al Patriarhiei refuză să-și ofere datele instituției care cercetează trecutul său în raport cu Securitatea. DOCUMENT EXCLUSIV

17 milioane de morți ai vaccinului și o tută. ”Amanta lui Cîțu” contrazice un studiu de 180 de pagini efectuat în 17 țări de oameni de știință cu reputație internațională cât și pe Tucker Carlson. Factual, ONG-ul cu un capital de 2.500.000 lei

Un profesor le scrie colegilor săi de la liceul George Barițiu din Baia Mare: Rușine, Domnilor Profesori! Scuipați-vă de trei ori pe zi. Dați-vă pumni! Dați-vă cu capul de pereți, doar s-o îndura Dumnezeu să vă dea un grăunte de minte. PENTRU VLAD ȚĂRANU!
Secțiuni: Sănătate
Persoane: Catalin Tolontan Dan Condrea
Subiecte: Scandalul dezinfectanților diluați
Organizații: Hexi Pharma Ministerul Sănătății
Tip conținut: Știri

 Cum au dispărut din analizele ICECHIM substanțe active ale dezinfectanților HEXI PHARMA
Cum au dispărut din analizele ICECHIM substanțe active ale dezinfectanților HEXI PHARMA  De ce puteau fi eficienți dezinfectanții de la HEXI PHARMA, chiar și diluați. EXCLUSIVITATE
De ce puteau fi eficienți dezinfectanții de la HEXI PHARMA, chiar și diluați. EXCLUSIVITATE
Autentifică-te sau înregistrează-te pentru a trimite comentarii.
Comentarii (0)